Emily Mullin scrive: "Charles Dupras, un bioeticista dell'Università di Montreal, che ha studiato i test epigenetici diretti al consumatore, afferma che le persone possono trarre beneficio da tali test perché servono da ispirazione per abitudini più sane. "Il solo fatto di avere questo strumento può servire come fonte positiva di motivazione per le persone", afferma. Ma dice che le aziende devono stare attente a non fare affermazioni esagerate sui potenziali benefici dei loro test. Inoltre, questi test non esistono da abbastanza tempo per sapere se effettivamente portano le persone a prendere decisioni più sane. Eric Verdin, presidente e CEO del Buck Institute for Research on Aging di Novato, in California, è entusiasta del potenziale dei test biologici sull'invecchiamento e il suo istituto è uno dei numerosi gruppi che li stanno sviluppando. "Sono ottimi strumenti di ricerca", afferma. “Ma questo è ancora l'inizio di questi test. Secondo me, non sono pronti per la prima serata. Per prima cosa, dice, non è chiaro se tutti i test sul mercato siano stati convalidati da altri scienziati. Verdin avverte inoltre che questi test non sono stati valutati dalla Food and Drug Administration degli Stati Uniti e non sono regolamentati. Sinclair non vede uno svantaggio nel conoscere la tua età biologica. "Avendo un numero, è come avere un cruscotto sul tuo corpo", dice. "Pensiamo che ti dia il potere, la determinazione per fare un cambiamento nella tua vita."
Test età biologica: La vita è un pranzo e la vecchiaia non ci rovinerà più la sua conclusione
TEORIE > CONCETTI > MEDICINA E GENETICA
Scopo di questa pagina
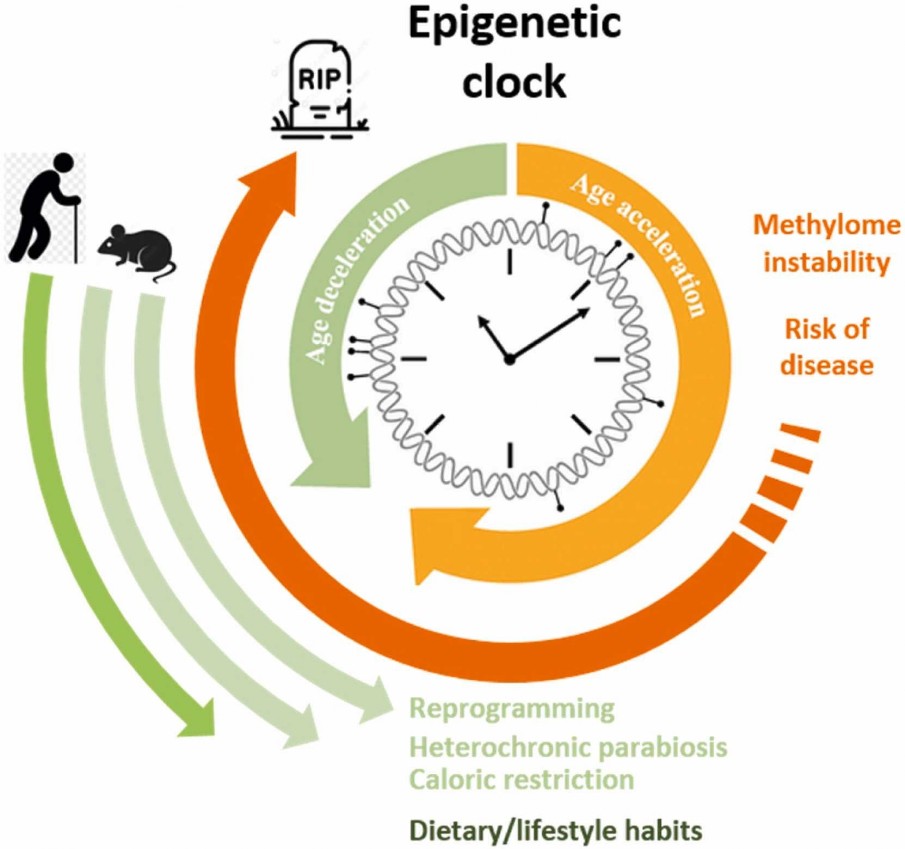
"Siamo ancora seduti a tavola e non abbiamo intenzione di alzarci, vogliamo goderci anche il dessert". Con una delle sue asserzioni fulminanti, coniata sulla analogia che dice "la vita è un pranzo", Lidia Ravera invita i suoi simili, gli over 65, i grandi adulti come li chiama lei, a gustare l'ultima pietanza alla festa dell'orgoglio di essere riusciti a diventare vecchi, l'Age Pride. Riuscire a diventare vecchi - salvo poi maledire il fatto di esserlo - è una conquista recente dell'umanità. [questo è l'incipit dell'articolo di Francesca Rigotti che, sul Sole24Ore del 19 marzo 2023, presenta il libro di Lidia Ravera "Age Pride. Per liberarci dei pregiudizi sull'età"]. E già...diventare vecchi, in passato, presentava ancora dei problemi soprattutto a carico del 'corpo', che è sottoposto a una 'deriva epigenetica' fin dal primo anno di vita di un bambino. Ma OGGI, il rischio di malattie legate all'età può essere contrastato da 'strategie' che rallentano il ticchettio dell'orologio epigenetico. Nel corso della vita, il profilo di metilazione del DNA genomico di una persona (metiloma) è permanentemente alterato da molteplici fattori. La perdita di integrità del metiloma durante l'invecchiamento e il conseguente aumento del rischio di malattia si riflettono nell'aumento dell'età epigenetica, misurata dall'orologio epigenetico. Il rischio di malattie legate all'età potrebbe essere ridotto mediante strategie che riducano o invertano il tasso di invecchiamento epigenetico. A differenza di ieri, OGGI sappiamo che le 'esperienze' di vita modificano il nostro epigenoma via via che invecchiamo, in base a quel che mangiamo, beviamo, fumiamo, incontriamo nell'ambiente in termini di persone e stress psicologici conseguenti. La Fondazione AIRC per la ricerca sul cancro, scrive: "L’epigenetica studia come l’età e l’esposizione a fattori ambientali, tra cui agenti fisici e chimici, dieta, attività fisica, possono modificare l’espressione dei geni pur senza modificare la sequenza del DNA. I meccanismi epigenetici che possono modificare l’espressione dei geni sono diversi e in molti casi reversibili. Le caratteristiche epigenetiche si modificano nel corso della vita e possono essere trasmesse sia da una cellula che si duplica alle cellule figlie, sia dai genitori alla prole. L’epigenetica può influenzare il rischio di sviluppare molte malattie, incluso il cancro. L’insieme dei composti che possono modificare in modo epigenetico l’espressione dei geni (epigenoma) è oggi al centro di molte ricerche anche in oncologia. In passato si pensava che l’espressione dei geni (cioè il modo e la frequenza in cui l’informazione in essi contenuta viene letta e tradotta in proteine) fosse determinata esclusivamente dalla sequenza dei geni stessi e di parti contigue, “scritte” nel DNA. Oggi sappiamo che a tale espressione contribuiscono molti meccanismi e molecole, tra cui quelli epigenetici. In greco il prefisso “epi” significa “sopra”. Di conseguenza il termine “epigenetica” indica qualcosa che si colloca al di “sopra” dei geni, e dunque del DNA e della sequenza di basi azotate di cui è composto. Nell’insieme i cambiamenti epigenetici nella regolazione dell’espressione dei geni possono determinare una modifica del fenotipo di una cellula, un tessuto, un organismo (ciò che vediamo come risultato dell’espressione dei geni), senza che sia per questo modificato il genotipo (la sequenza del DNA dei nostri geni). Con una metafora attinta dalla lingua scritta, possiamo considerare le modifiche epigenetiche sulla sequenza di DNA come gli accenti posti sulle parole: non cambiano la sequenza di lettere di cui è fatta la parola, ma il modo in cui questa viene pronunciata e dunque compresa. L’epigenetica può influenzare la regolazione dell’espressione genica con diversi meccanismi, ma tre sono le vie più note e studiate attraverso le quali agisce: (1) la metilazione del DNA, (2) la modifica degli istoni e (3) l’azione degli RNA non codificanti. La metilazione del DNA consiste nell’aggiunta di un gruppo chimico (metile, formula -CH3) in punti specifici del DNA. In genere la metilazione blocca l’espressione del gene e di fatto lo inattiva, per esempio impedendo ad apposite proteine di trascrivere il DNA. Il processo opposto, ovvero la rimozione del gruppo metile, è detto demetilazione e, in genere, può portare a riattivare un gene, permettendone l’espressione. L’epigenoma è l’insieme di tutte le molecole che rendono possibili i cambiamenti epigenetici presenti nell’organismo." La ricercatrice biologica Anna Reale e i suoi colleghi (vedi bibliografia 2022) scrivono: "Gli “orologi epigenetici”, traducono il profilo di metilazione genomica in una “età epigenetica”. L'età epigenetica non solo stima l'età cronologica, ma può anche prevedere il rischio di malattie croniche e mortalità. Si ritiene che l'età epigenetica sia una delle metriche più accurate dell'età biologica". Al fine di invertire l'età epigenetica (o biologica) ricercatori hanno individuato i seguenti metodi: (1) PARABIOSI ETEROCRONICA [infusioni di sangue giovane in organismi vecchi], (2) RESTRIZIONE CALORICA [la restrizione dietetica abbassa i livelli di biomarcatori sistemici dell'invecchiamento e anche molteplici fattori di rischio di cancro e malattie cardiovascolari in individui sani], (3) RIPROGRAMMAZIONE CELLULARE [trasferimento nucleare di cellule somatiche (SCNT) e creazione di cellule staminali pluripotenti indotte (iPSC)], (4) FATTORI AMBIENTALI [l'azione dell'ambiente sulla variazione dell'orologio epigenetico sembra prevalere su quella dei fattori genetici]. L'epigenoma è la nostra storia personale, tutto ciò che ci è successo nel tempo e nello spazio hanno agito su di noi, lasciando tracce visibili. Se il nostro pranzo è stato cattivo è una nostra responsabilità. Se abbiamo condotto una vita sregolata e adesso vogliamo recuperare i nostri errori è oggi (in parte) possibile.
La nostra età biologica
Ho scoperto la mia età biologica e sono rimasto infastidito dal risultato. (Jessica Hamzelou)
(Cliccare per approfondire)
(Cliccare per approfondire)
Punto chiave di questa pagina
OROLOGI EPIGENETICI: La ricercatrice biologica Anna Reale et al. scrivono: "Nonostante sia in una fase iniziale, la ricerca sugli orologi epigenetici si preannuncia un successo. La loro capacità di stimare l'età biologica in diversi tessuti suggerisce che sono in grado di catturare gli effetti di un meccanismo pervasivo, che agisce a livello di sistema (Jylhävä et al., 2017). Inoltre, il recente sviluppo di orologi DNAm in grado di stimare con precisione l'età in molte specie di mammiferi suggerisce che gli orologi riflettono l'attività di meccanismi specifici e condivisi, che sono alla base del processo di invecchiamento".
Punti di riflessione
In condizioni ideali, qualsiasi cellula, dopo aver subìto un danno, è solitamente in grado di auto-ripararsi senza problemi. Questo fatto, unito alla capacità delle cellule di riprodursi, sta alla base dei meccanismi biologici che rendono possibile la vita di un organismo differenziandolo da qualsiasi altra macchina costruita dall'uomo. (Fabio Piccini p.31)
_
L'epigenetica è lo studio di come il tuo ambiente cambia il modo in cui funzionano i tuoi geni. L'orologio di Horvath analizza alcuni cambiamenti chimici nel materiale genetico, un processo chiamato metilazione del DNA. Nel 2011, Horvath ha scoperto che i modelli di metilazione del DNA potrebbero essere utilizzati per stimare con precisione l'età umana. (Wilfred Chan)
-
Ciò che mangia la nostra mamma in gravidanza e ciò che noi assumiamo nei primi anni di vita contribuiscono a determinare il nostro profilo epigenetico, ma anche il cibo che ha consumato il papà ha un ruolo, dal momento che alcune modifiche epigenetiche possono essere trasmesse da entrambi i genitori. (Fondazione AIRC)
-
L’epigenoma è un sistema che cambia continuamente nel corso della vita di un individuo e che reagisce rapidamente all’influenza dell’ambiente. Il bruco e la farfalla sono lo stesso organismo, possiedono lo stesso DNA, eppure esibiscono fenotipi diversi in diverse fasi dello sviluppo: il genoma resta lo stesso, ma l’epigenoma cambia. L’ape operaia, il fuco e l’ape regina di un alveare hanno lo stesso DNA, ma sono nutriti in maniera diversa (la regina mangia la pappa reale) e queste differenze ambientali si ripercuotono a livello morfologico, comportamentale e dunque a livello epigenetico. All’interno di un medesimo formicaio, le formiche hanno lo stesso DNA, ma possono essere soldato o operaie, con fenotipi morfologici e comportamentali diversi. Uno studio pubblicato su Science nel 2016 ha trovato che alcune di queste differenze comportamentali dipendono dall’alimentazione, la quale a sua volta si riflette in differenti pattern epigenetici di acetilazione istonica di alcuni geni di cellule neuronali. (Francesco Suman)
-
La metilazione del DNA (DNAm) sovrascrive le informazioni su più fattori estrinseci sul genoma. L'età è uno di questi fattori. L'età provoca cambiamenti caratteristici del DNAm che si pensa siano non solo i principali motori del normale invecchiamento, ma anche precursori di malattie, tra cui il cancro è uno di questi. (Anna Reale et al.)
-
I meccanismi di regolazione epigenetica fanno esattamente questo: se il genoma è un libro intonso, l’epigenoma è l’insieme di appunti, etichette e sottolineature che servono a ricordare i punti salienti da andare a recuperare. (Francesco Suman)
_
Gli “orologi epigenetici”, traducono il profilo di metilazione genomica in una “età epigenetica”. L'età epigenetica non solo stima l'età cronologica, ma può anche prevedere il rischio di malattie croniche e mortalità. Si ritiene che l'età epigenetica sia una delle metriche più accurate dell'età biologica. (Anna Reale et al.)
_
In linea con il tasso di crescita senza precedenti della popolazione mondiale che invecchia (Harper, 2014, Kaeberlein et al., 2015, Moffitt, 2020), vi è una chiara necessità di biomarcatori in grado di prevedere la capacità funzionale di tessuti, organi e persino dell'intero individuo in modo accurato. Inoltre, i biomarcatori dovrebbero dare una valutazione dell'età biologica, fornendo così informazioni utili per la valutazione del tasso di invecchiamento di un individuo e del suo rischio di malattie legate all'età. Tuttavia, nonostante i grandi sforzi compiuti negli ultimi decenni, ad oggi non è emerso alcun marcatore di questo tipo (Jylhävä et al., 2017). (Anna Reale et al.)
-
Tra le malattie legate all'età, il cancro è quella in cui è più evidente il ruolo dell'invecchiamento epigenetico. Il cancro è una malattia derivante dall'accumulo di alterazioni genetiche ed epigenetiche e, per diversi tumori, il fattore di rischio più importante è l'età (Age and Cancer Risk, National Cancer Institute, www.cancer.gov). (Anna Reale et al.)
-
Sebbene il livello di istruzione possa essere considerato un fattore ambientale biologicamente distante dalla metilazione del DNA, l'impatto dell'istruzione sull'accelerazione dell'età epigenetica era paragonabile e indipendente da altri fattori legati allo stile di vita come il fumo, il BMI, l'alcol e l'attività fisica. Ciò suggerirebbe che si può ottenere un vantaggio di invecchiamento epigenetico sfruttando l'istruzione al di là di altri fattori ambientali/stile di vita modificabili. Un ulteriore supporto a questa ipotesi viene da studi che suggeriscono che gli individui che hanno sperimentato un miglioramento del contesto sociale e del livello di istruzione per tutta la vita, in particolare durante la prima infanzia, hanno tassi di invecchiamento epigenetico più lenti (Austin et al., 2018, Fiorito et al., 2017, Gomez-Verjan et al., 2021, Hughes et al., 2018). (Anna Reale et al.)
_
La sensibilità all'influenza ambientale osservata in periodi successivi non è così forte come durante il periodo fetale (Guintivano e Kaminsky, 2016, Heim e Binder, 2012). In linea con queste osservazioni, alcuni studi indicano che il tasso di progressione dell'orologio epigenetico è ampiamente stabilito prima dell'età adulta. (Kananen et al., 2016, Li et al., 2020 ). Ciò è particolarmente significativo in quanto molte delle associazioni riscontrate in età successive potrebbero essere correlate a esposizioni precoci. Infatti, uno studio longitudinale su un'ampia coorte di anziani mostra che l'associazione tra età di metilazione del DNA e molti fenotipi (inclusi i fenotipi del sangue, fisici, cognitivi e dello stile di vita, nonché la mortalità) dipende in gran parte sia dall'abilità cognitiva generale misurata all'età di 11 anni e il numero di anni di istruzione. Infatti, l'aggiustamento per le capacità cognitive all'età di 11 anni ha attenuato la maggior parte delle associazioni trasversali riscontrate in età avanzata (Stevenson et al., 2019). (Anna Reale et al.)
-
Per quanto riguarda l'età epigenetica, sebbene si sappia molto poco su ciò che controlla l'orologio epigenetico, diversi lavori hanno fornito stime della sua ereditabilità , che appare essere piuttosto moderata, essendo spesso inferiore al 50% (Horvath, 2013, Levine et al. ., 2015b, Marioni et al., 2015a). Di conseguenza, l'azione dell'ambiente sulla variazione dell'orologio epigenetico sembra prevalere su quella dei fattori genetici. (Anna Reale et al.)
-
Sulla vecchiaia non era opportuno indagare. Mai, nè da piccoli nè da grandi. Le persone educate non invecchiano. Fine delle comunicazioni. Nel 1960 gli italiani ultrasessantacinquenni erano il 9% della popolazione, oggi sono il 23 per cento. Nel 1960 inoltrarsi al di là dei settant'anni era una rarità. Un privilegio da benestanti. Una fortuna. Un eroismo. Oggi la vecchiaia è un fenomeno di massa. Vecchi siamo tanti. Non facciamo più notizia. Non facciamo più invidia. Ma neppure pena. (Lidia Ravera Age Pride p.5)
-
Negli anni '70, gli scienziati hanno stabilito il collegamento tra la metilazione del DNA e l'invecchiamento. Nel 2013, Steven Horvath, genetista e biostatistico dell'UCLA, ha pubblicato il primo "orologio" dell'invecchiamento epigenetico basato su questi cambiamenti. L'orologio è un test predittivo basato sui dati di 8.000 campioni biologici di 51 tessuti umani sani e tipi di cellule. Misura i modelli di metilazione del DNA associati all'invecchiamento e alle malattie e utilizza un algoritmo per indovinare l'età di una persona. (Emily Mullin)
-
"Pensiamo che alcune persone invecchino più lentamente e vivano una vita lunga e sana, mentre altre invecchiano più rapidamente e hanno un'insorgenza precoce di malattie croniche", afferma Daniel Belsky, professore associato di epidemiologia alla Columbia University che si occupa di invecchiamento. "L'età biologica è un modo per cercare di riassumere queste differenze tra le persone". (Emily Mullin)
Lidia Ravera scrive in Age Pride (p.16): "Nel giro di una generazione, con i progressi della scienza, con l'entusiasmo e i miliardi che Mr Google, Larry Page, sta investendo per rendere se stesso, e quindi anche molte di noi, immortali, nel giro di una generazione, due al massimo, restare per sempre giovani sarà un progetto realizzabile, non più un sogno ricorrente. La morte non verrà abolita, ma sarà possibile procrastinarla, pagando quel che è giusto".
Il rischio di malattie legate all'età può essere contrastato da strategie che rallentano il ticchettio dell'orologio epigenetico. Nel corso della vita, il profilo di metilazione del DNA genomico di una persona (metiloma) è permanentemente alterato da molteplici fattori intrinseci ed estrinseci. I loro effetti vengono registrati come una sorta di memoria epigenetica e propagati nel tempo. La perdita dell'integrità del metiloma può comportare una progressiva compromissione dei meccanismi omeostatici del corpo, influenzando il carico e la resistenza della malattia. La perdita di integrità del metiloma durante l'invecchiamento e il conseguente aumento del rischio di malattia si riflettono nell'aumento dell'età epigenetica, misurata dall'orologio epigenetico.
Eterogeneità nell'invecchiamento dei vari tessuti del corpo umano
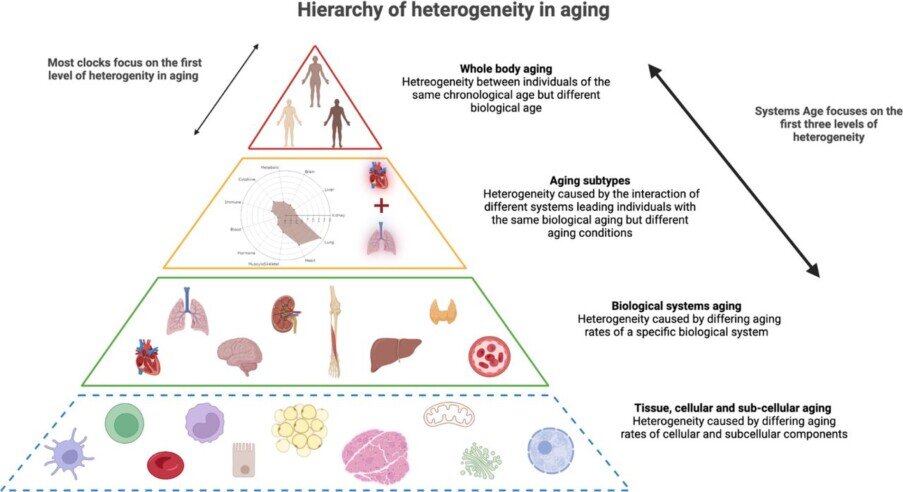
I nostri sistemi organici, i nostri organi, e i loro tessuti, invecchiano con modalità e velocità differenziate, come scrive un gruppo di ricercatori guidati da Morgan Levine, recensiti dal giornalista scientifico Arkadi Mazin (vedi bibliografia 2023) che scrive:
L'ex professore di Yale Morgan Levine, che ora è con Altos Labs, è una delle massime autorità sugli orologi di metilazione e l'abbiamo intervistato sull'argomento. Il suo gruppo ha inventato l'orologio avanzato PhenoAge insieme a un metodo per ridurre la variabilità degli orologi esistenti tramite l'analisi delle componenti principali. In questo nuovo documento di prestampa, Morgan e i suoi coautori descrivono Systems Age, un orologio in lavorazione da un po' di tempo. Questo orologio ha lo scopo di discernere tra diversi modelli di invecchiamento. I ricercatori descrivono diversi livelli di eterogeneità nell'invecchiamento. La prima e ovvia è la differenza nell'invecchiamento dell'intero corpo tra gli individui: le persone che hanno la stessa età cronologica differiscono nella loro età biologica misurata dagli odierni orologi di metilazione. Tuttavia, ci sono anche livelli più fondamentali. Gli elementi subcellulari, le cellule, i tessuti, gli organi e i sistemi invecchiano in modo diverso, il che crea sottotipi di invecchiamento distintivi. Systems Age funziona su questi livelli inferiori, catturando le differenze interpersonali in maggiore dettaglio. "Due individui possono avere diversi profili di metilazione del DNA che producono la stessa identica età epigenetica calcolata dagli orologi epigenetici basati sul sangue", spiegano i ricercatori, "eppure potrebbero deteriorarsi fisiologicamente in sistemi completamente diversi". Tenere conto di queste differenze può essere estremamente utile per la ricerca sull'invecchiamento, nonché per la prevenzione, il rilevamento e il trattamento personalizzati.
Systems Age è stato addestrato sui biomarcatori di chimica clinica ed ematologia specifici del sistema dallo studio Health and Retirement. È stato incorporato anche un modello di previsione della mortalità. L'orologio include 11 punteggi specifici del sistema, come muscoloscheletrico, cardiaco, infiammazione e un punteggio completo dell'età dei sistemi che "riunifica" quei punteggi in un'unica misurazione dell'età biologica. La specificità dei punteggi del sistema è stata valutata utilizzando i dati di uno studio diverso. I ricercatori hanno testato le associazioni con l'incidenza della malattia, la prevalenza della malattia e vari parametri funzionali dell'invecchiamento. I test hanno mostrato alti livelli di correlazione tra i punteggi di sistema e i corrispondenti fenotipi di invecchiamento (ad esempio, tra punteggio cerebrale e cognizione, punteggio cardiaco ed eventi cardiovascolari e punteggio muscoloscheletrico e diabete). È interessante notare che il punteggio dell'infiammazione era altamente correlato con il carico totale delle comorbilità al basale, a sostegno dell'ipotesi che l'infiammazione abbia un effetto particolarmente ampio e su più fronti sull'invecchiamento. I ricercatori hanno quindi confrontato i loro punteggi di sistema con tre orologi di livello superiore esistenti, GrimAge, PhenoAge e DunedinPACE, utilizzando vari risultati di invecchiamento. I relativi punteggi di sistema si sono dimostrati più predittivi dei tre orologi per 10 malattie su 14 e si sono avvicinati al secondo posto nelle altre. Sebbene in alcuni casi gli orologi esistenti fossero leggermente più accurati, i punteggi del sistema erano più coerenti, dimostrando che sono meno distorti verso particolari fenotipi di invecchiamento. Secondo gli autori, "questi risultati suggeriscono che avere punteggi diversi per ciascun sistema può catturare in modo più preciso il rischio rilevante per la malattia e facilitare interventi personalizzati rispetto a una singola metrica globale".
Morgan Levine ha dichiarato a Lifespan.io:
Gli orologi epigenetici mostrano robuste correlazioni di età e possono essere applicati universalmente a quasi tutti i tessuti o biofluidi. Tuttavia, gli orologi esistenti forniscono solo un singolo valore inteso a rappresentare l'età prevista o il tasso di invecchiamento nell'organo o nel biofluido da cui è stato prelevato il campione di DNA. Questo nonostante sappiamo che non tutte le cellule, i tessuti o persino gli organi del nostro corpo invecchiano alla stessa velocità. Ad oggi, l'unico modo per valutare l'invecchiamento differenziale tra i sistemi di organi utilizzando orologi epigenetici è stato quello di prelevare biopsie e quindi profilare ciascun organo individualmente. Per risolvere questo problema, abbiamo sviluppato più nuovi orologi di metilazione basati su sistemi che, se valutati nel sangue utilizzando un singolo campione di DNA e analisi, catturano l'invecchiamento in distinti sistemi fisiologici.
L'epigenoma e le influenze ambientali
La Fondazione AIRC scrive:
Accanto al genoma, l’insieme dei geni che compone il nostro DNA, i ricercatori studiano oggi anche l’epigenoma, ovvero l’insieme di tutte le molecole che rendono possibili i cambiamenti epigenetici presenti nell’organismo. Una prima grande differenza tra genoma ed epigenoma risiede nel fatto che, mentre il primo si mantiene piuttosto costante per tutta la vita e in tutte le cellule, il secondo cambia nel corso della nostra esistenza ed è diverso anche tra cellula e cellula. L’epigenoma entra in gioco molto presto, sin dalle prime fasi dello sviluppo dell’embrione. Grazie anche a un epigenoma differente, infatti, due cellule che possiedono lo stesso identico DNA possono differenziarsi e dare origine a tipi cellulari molto diversi tra loro: neuroni, cellule epidermiche, epatociti eccetera. Il tutto, anche perché determinati meccanismi epigenetici inattivano alcuni geni e ne attivano altri. Le caratteristiche epigenetiche cambiano anche con gli anni. Valutando, per esempio, la metilazione del DNA in milioni di siti in tre diverse fasi della vita, è stato dimostrato che il livello maggiore è raggiunto nei neonati, per poi diminuire negli adulti e raggiungere il livello più basso negli anziani.
I ricercatori biologici Anna Reale et al. in un loro studio (vedi bibliografia 2023) scrivono:
Diverse teorie sono state proposte per spiegare il meccanismo alla base dell'invecchiamento e la sua connessione con la malattia. Sebbene nessuna teoria sia stata definitivamente dimostrata, prove crescenti suggeriscono che un cambiamento delle informazioni epigenetiche nel tempo potrebbe essere alla base del deterioramento cellulare associato all'età ( Horvath e Raj, 2018 , Liu e Zhu, 2021 , Lopez-Otin et al., 2013 ). In realtà, ora ci sono ampie prove che le variazioni epigenetiche sono regolatori ubiquitari del processo di invecchiamento in vari organismi. Gli studi isogenici negli animali hanno collegato i cambiamenti epigenetici con i fenotipi dell'invecchiamento e la durata della vita ( Jin et al., 2019 , Kucharski et al., 2008 , Treviño et al., 2020 ). Lo stato epigenetico cellulare deriva da un'interazione dinamica tra diversi componenti, di cui la metilazione del DNA (DNAm) è solo uno e sono incluse anche le varianti istoniche e le modifiche post-traduzionali dell'istone (PTM). Tuttavia, il DNAm è la modificazione epigenetica in cui la conoscenza del suo legame con l'invecchiamento è la più avanzata (Ciccarone et al., 2018, Zampieri et al., 2015). Infatti, il DNAm è attualmente il marcatore molecolare più promettente per monitorare l'invecchiamento e prevedere l'aspettativa di vita negli esseri umani. Ciò è particolarmente rafforzato dal recente sviluppo di stimatori dell'età biologica basati sul DNAm, i cosiddetti orologi epigenetici (Bell et al., 2019, Horvath e Raj, 2018, Liu e Zhu, 2021). Questi orologi stanno emergendo non solo come metriche semplici e utili per monitorare accuratamente l'invecchiamento e i relativi esiti di salute, ma anche un mezzo per valutare l'efficacia degli interventi che attenuano l'invecchiamento modificando l' epigenoma. Il DNAm è un marchio epigenetico, presente praticamente in tutti i regni eucariotici, ed è funzionalmente associato al modello di espressione genica e allo sviluppo dell'organismo (Aliaga et al., 2019 , Skinner, 2011). In questo processo biologico, i gruppi metilici vengono trasferiti alla posizione C-5 delle citosine del DNA , culminando nella sintesi di 5-metilcitosina (5mC) nei dinucleotidi CpG palindromi (siti CG) (Greenberg e Bourc'his, 2019). Nonostante formino una piccola frazione dell'intero genoma dei mammiferi (<2%), le regioni ricche di siti CG di circa 1 kb, le cosiddette isole CpG , sono strettamente incorporate in oltre i due terzi dei promotori genici dei mammiferi annotati. Attraverso i 28 milioni di siti CG del genoma umano, circa il 60-80% è costantemente metilato nelle cellule somatiche , mentre il pezzo residuo delle posizioni del genoma CG comprende citosine non metilate (Edwards et al., 2010 , Illingworth et al., 2010). [...] Da un punto di vista evolutivo, il meccanismo della metilazione della citosina non si trova in molti eucarioti, inclusi diversi animali come Drosophila melanogaster e Caenorhabditis elegans. Il DNAm dei mammiferi è determinato e configurato in tre fasi distinte: costituzione ( de novo DNAm), mantenimento e rimozione di 5mC (Li e Zhang, 2014).
In primo luogo, la costituzione di DNAm è determinata dall'attività di due metiltransferasi , DNMT3A e DNMT3B , che danno forma allo specifico modello di metilazione genomica per ciascuna cellula germinale o cellula somatica ( Fig. 1 ). Questo passaggio è fondamentale, poiché coordina il corretto DNAm dell'intero genoma dopo la demetilazione globale nelle cellule germinali primordiali e negli embrioni precoci, un processo necessario per il ritorno della pluripotenza dopo la specificazione e la fecondazione delle cellule germinali (Jones, 2012 , Messerschmidt et al., 2014).
Il metiloma che invecchia: quando nasce la deriva epigenetica
La ricercatrice biologica Anna Reale et al. (vedi bibliografia 2023) scrivono:
Le prove dagli esseri umani sono state raccolte durante l'intera durata della vita. Studi longitudinali su bambini piccoli hanno dimostrato che i livelli di 5mC cambiano già nel primo anno di vita (Martino et al., 2011). Il DNAm inizia anche a divergere molto presto nei gemelli monozigoti ( Martino et al., 2013, Martino et al., 2011). Significativamente, le differenze di DNAm tra i gemelli monozigoti diventano ancora più pronunciate man mano che invecchiano, in particolare nei gemelli che hanno abitudini diverse e vivevano separati l'uno dall'altro (Fraga et al., 2005 Tan et al., 2016). Ciò supporta chiaramente la teoria secondo cui i modelli DNAm associati all'invecchiamento possono derivare dall'interazione tra l'ambiente e i modelli genetici. Questo fenomeno di divergenza epigenetica è definito "deriva epigenetica", secondo cui l'invecchiamento si traduce in una ridotta stabilità epigenetica. Ciò si manifesta con un graduale allontanamento del genoma da un profilo DNAm di base condiviso e con una maggiore variabilità epigenetica interindividuale (Fraga et al., 2005, Issa, 2014, Jones et al., 2015,Tan et al., 2016)
Una dieta di alta qualità è uno dei fattori modificabili che possono comportare una più lenta accelerazione dell'invecchiamento epigenetico e portare a una durata di vita più lunga e più sana, anche in individui con uno stile di vita malsano (ad esempio fumatori o individui sedentari). [...] Oltre ai fattori dietetici, è stato riscontrato che una ridotta accelerazione dell'età epigenetica è associata a una maggiore attività fisica in più studi. [...] Un possibile effetto riducente sull'accelerazione epigenetica dell'età si estende anche ai fattori sociali. Un'associazione inversa tra l'accelerazione epigenetica dell'età e il livello di istruzione è ricorrente in più studi. [...] Di questi, i risultati di Fiorito, (Fiorito et al. (2019) sono particolarmente promettenti in quanto confermano le osservazioni precedenti in un campione molto ampio di coorti e paesi. Sebbene il livello di istruzione possa essere considerato un fattore ambientale biologicamente distante dalla metilazione del DNA, l'impatto dell'istruzione sull'accelerazione dell'età epigenetica era paragonabile e indipendente da altri fattori legati allo stile di vita come il fumo, il BMI, l'alcol e l'attività fisica. Ciò suggerirebbe che si può ottenere un vantaggio di invecchiamento epigenetico sfruttando l'istruzione al di là di altri fattori ambientali/stile di vita modificabili. Un ulteriore supporto a questa ipotesi viene da studi che suggeriscono che gli individui che hanno sperimentato un miglioramento del contesto sociale e del livello di istruzione per tutta la vita, in particolare durante la prima infanzia, hanno tassi di invecchiamento epigenetico più lenti (Austin et al., 2018, Fiorito et al., 2017, Gomez-Verjan et al., 2021, Hughes et al., 2018). Questo possibile effetto anti-invecchiamento dei fattori ambientali è supportato anche da recenti analisi trasversali delle popolazioni migranti. Una sorprendente riduzione dell'età epigenetica corrisponde al miglioramento del contesto ambientale e alla transizione sanitaria che di solito sono conseguenti alla migrazione (Chilunga et al., 2021, Horvath et al., 2016). In effetti, la migrazione da un paese a basso reddito a uno ad alto reddito è associata a cambiamenti in molteplici fattori ambientali, tra cui lo stile di vita e un migliore accesso ai servizi sanitari. Secondo il cosiddetto "effetto migrante sano" (Wallace et al., 2019), questi cambiamenti ambientali spiegano il miglioramento dello stato di salute e il vantaggio in termini di mortalità degli individui migranti rispetto ai non migranti. [...] Tutto sommato, i risultati di questi studi suggeriscono che i livelli e i tassi di cambiamento delle traiettorie di salute durante la vita e la vecchiaia possono essere modificati da una combinazione di fattori ambientali correlati alla salute, tra cui abitudini alimentari, fattori comportamentali (ad es. e fattori sociali contestuali (ad es. istruzione e partecipazione sociale), che possono rallentare l'invecchiamento epigenetico. Uno studio longitudinale su un'ampia coorte di anziani mostra che l'associazione tra età di metilazione del DNA e molti fenotipi (inclusi i fenotipi del sangue, fisici, cognitivi e dello stile di vita, nonché la mortalità) dipende in gran parte sia dall'abilità cognitiva generale misurata all'età di 11 anni e il numero di anni di istruzione. Infatti, l'aggiustamento per le capacità cognitive all'età di 11 anni ha attenuato la maggior parte delle associazioni trasversali riscontrate in età avanzata (Stevenson et al., 2019).
Anna Reale et al. scrivono: "Nonostante sia in una fase iniziale, la ricerca sugli orologi epigenetici si preannuncia un successo. La loro capacità di stimare l'età biologica in diversi tessuti suggerisce che sono in grado di catturare gli effetti di un meccanismo pervasivo, che agisce a livello di sistema (Jylhävä et al., 2017). Inoltre, il recente sviluppo di orologi DNAm in grado di stimare con precisione l'età in molte specie di mammiferi suggerisce che gli orologi riflettono l'attività di meccanismi specifici e condivisi, che sono alla base del processo di invecchiamento".
Alcuni orologi epigenetici, oggi, disponibili
Elysium: 299$ (dr. Morgan Levine) (solo USA e Canada)
myDNAge: 299$ (dr. Horvath) (solo USA)
GlycanAge:348€ (dr. Gordan Lauc) (tutto il mondo)
TallyHealth: 229$ (dr. David Siclair) (tutto il mondo)
Purovitalis: 222€ (dr. Moshe Szyf) (tutto il mondo)
La ricercatrice biologica Anna Reale et al. scrivono: "Sebbene il livello di istruzione possa essere considerato un fattore ambientale biologicamente distante dalla metilazione del DNA, l'impatto dell'istruzione sull'accelerazione dell'età epigenetica era paragonabile e indipendente da altri fattori legati allo stile di vita come il fumo, il BMI, l'alcol e l'attività fisica. Ciò suggerirebbe che si può ottenere un vantaggio di invecchiamento epigenetico sfruttando l'istruzione al di là di altri fattori ambientali/stile di vita modificabili. Un ulteriore supporto a questa ipotesi viene da studi che suggeriscono che gli individui che hanno sperimentato un miglioramento del contesto sociale e del livello di istruzione per tutta la vita, in particolare durante la prima infanzia, hanno tassi di invecchiamento epigenetico più lenti (Austin et al., 2018, Fiorito et al., 2017, Gomez-Verjan et al., 2021, Hughes et al., 2018). Questo possibile effetto anti-invecchiamento dei fattori ambientali è supportato anche da recenti analisi trasversali delle popolazioni migranti. Una sorprendente riduzione dell'età epigenetica corrisponde al miglioramento del contesto ambientale e alla transizione sanitaria che di solito sono conseguenti alla migrazione (Chilunga et al., 2021, Horvath et al., 2016). In effetti, la migrazione da un paese a basso reddito a uno ad alto reddito è associata a cambiamenti in molteplici fattori ambientali, tra cui lo stile di vita e un migliore accesso ai servizi sanitari. Secondo il cosiddetto "effetto migrante sano" (Wallace et al., 2019), questi cambiamenti ambientali spiegano il miglioramento dello stato di salute e il vantaggio in termini di mortalità degli individui migranti rispetto ai non migranti"
Lidia Ravera scrive in Age Pride (p.17): "Restare per sempre giovani, in fondo, qualora fosse già possibile, sarebbe mortalmente noioso. Un paese senza inverno, senza cambio di stagioni, inchiodato a ottusi cieli azzurri, mai un temporale, mai un cono d'ombra, sempre esposti, tutti, ai raggi, per lo più nocivi della ricerca di piaceri sensuali e soddisfazioni personali, tutta la vita a investire energie per la propria riuscita, costretti a competere, vulnerabili alla gelosia, facili allo sconforto, oppressi da pretese celesti, a ogni cena, a ogni festa, a ogni vacanza
Indicazioni scientificamente credibili, su come misurare la propria età biologica e invertire il proprio invecchiamento, sono state date dal genetista David Sinclair e riportate alla pagina "Nutraceutica di David Sinclair".
Dall'età biologica all'età funzionale attraverso più biomarcatori
Il giornalista scientifico Danny Sullivan, sui problemi incontrati dalla misura dell'età biologica nelle persone più giovani, scrive (vedi bibliografia 2023):
"Sappiamo che questi orologi epigenetici sono estremamente accurati nel correlare all'età cronologica, ma non sono bravi a riflettere le capacità funzionali, in particolare nei più giovani", afferma. “Ci sono stati molti studi che dimostrano che un’età epigenetica inferiore non è collegata ad alcun miglioramento nelle misure funzionali come l’idoneità cardiorespiratoria, la velocità di camminata e la forza muscolare. Quindi la tua età epigenetica non riflette quanto giovane ti senti effettivamente e potrebbe non riflettere le capacità fisiche e cognitive del tuo corpo. “Ci sono molti dati che suggeriscono che le persone che si sentono più giovani vivono più a lungo e abbiamo ritenuto che fosse importante riflettere questa correlazione in un calcolo. Questo è il divario che abbiamo identificato nell’attuale panorama dell’orologio biologico”. [...] "Man mano che riduci la tua età funzionale, man mano che migliori la tua funzionalità fisica, vogliamo un orologio che possa rifletterlo", afferma Cooney. "E volevamo anche un orologio che riflettesse la tua esperienza vissuta, in modo che le persone che balzano fuori dal letto la mattina e si sentono benissimo possano poi guardare il loro orologio e vedere qualcosa che rifletta effettivamente come si sentono." Il concetto di età funzionale è già ben compreso nel campo dell’assistenza agli anziani, ma Zest mira a renderlo rilevante per un gruppo demografico molto più giovane. "Ho lavorato nel settore dell'assistenza agli anziani e molte misure sono estremamente interessanti, ma non sono rilevanti per la popolazione più giovane", afferma Cooney. "Abbiamo molte ricerche finanziate dal governo sulla misurazione della fragilità, ma misurare la funzionalità fisica nella popolazione più giovane non è qualcosa che abbia mai avuto bisogno di essere studiato o finanziato come parte di un progetto di ricerca." Al centro dell’algoritmo di Zest ci sono biomarcatori digitali, funzionali e sanguigni che, secondo Cooney, sono “pratici, olistici, funzionali e riflettono l’esperienza vissuta”. "I biomarcatori del sangue che abbiamo selezionato sono quelli che hanno dimostrato più e più volte di essere molto ben correlati alla durata della salute e della vita", afferma. Questi includono marcatori consolidati del pannello sanguigno come HDL, LDL, albumina, CRP per l'infiammazione, glucosio e HbA1c per il metabolismo del glucosio e ormoni come estrogeni, testosterone, SHBG e DHEAS. I biomarcatori digitali raccolti come parte del calcolo dell'età funzionale di Zest includono elementi come VO2max, variabilità della frequenza cardiaca e qualità del sonno. [...] L'algoritmo AI di Zest confronta quindi tutte le misurazioni con valori di riferimento e fattori corrispondenti all'età nella tua età cronologica per fornire una stima dell'età funzionale, che, afferma Cooney, "riflette le tue prestazioni fisiche e cognitive nella tua vita quotidiana .”
Conclusioni (provvisorie): L'epigenoma è la nostra storia personale, tutto ciò che ci è successo nel tempo e nello spazio hanno agito su di noi, lasciando tracce visibili. Se abbiamo condotto una vita sregolata e adesso vogliamo recuperare i nostri errori è oggi (in parte) possibile.
per scaricare le conclusioni (in pdf):
La razionalità richiede impegno personale!
Iscriviti alla Newsletter di pensierocritico.eu per ricevere in anteprima nuovi contenuti e aggiornamenti:
Iscriviti alla Newsletter di pensierocritico.eu per ricevere in anteprima nuovi contenuti e aggiornamenti:
Bibliografia (chi fa delle buone letture è meno manipolabile)
Catherine Roberts (2021), Read This Before You Buy a Genetic Testing Kit - Consumer reports
Arkadi Mazin (2023), New System-Specific Epigenetic Clocks Revealed - Lifespan.io
- Emily Mullin (2023), How Old Are You, Really? New Tests Want to Tell You - Wired
- David Sinclair et al. (2021), TIME-Seq Enables Scalable and Inexpensive Epigenetic Age Predictions - bioRxyv
- Wilfred Chan (2022), Real age versus biological age: the startups revealing how old we really are - The Guardian
- Danny Sullivan (2023), Measuring longevity: Making the case for functional age - Longevity.Technology
- Adiv A. Johnson et al. (2022), A set of common buccal CpGs that predict epigenetic age and associate with lifespan-regulating genes
Scrivi, se non sei d'accordo
Se ritenete che le tesi del "punto chiave" non vengano sufficientemente supportate dagli argomenti presenti in questa pagina potete esprimere il vostro parere (motivandolo).
Inviate una email con il FORM. Riceverete una risposta. Grazie della collaborazione.
Guarda le pagine correlate
Libri consigliati
a chi vuole capire come e quanto è invecchiato il proprio organismo
Spesa annua pro capite in Italia per gioco d'azzardo 1.583 euro, per l'acquisto di libri 58,8 euro (fonte: l'Espresso 5/2/17)
Pagina aggiornata il 13 settembre 2023